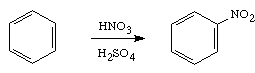แอลไคน์ (Alkynes)
แอลไคน์เป็นสารประกอบไฮโดรคาร์บอนที่ไม่อิ่มตัวประเภทที่มีพันธะสามอยู่ในโมเลกุลมีสูตรโมเลกุลทั่ว
ๆ ไปเป็น CnH2n-2 สารประกอบตัวแรกของแอลไคน์
คือ อะเซทิลีน(C2H2) สารตัวนี้จัดเป็นสารประกอบที่มีประโยชน์ในทางอุตสาหกรรมมากที่สุดชนิดหนึ่ง
ใช้ทำเชื้อเพลิง ใช้สำหรับเชื่อมโลหะโดยผสมกับออกซิเจน
ใช้เตรียมสารอินทรีย์ที่ใช้ทำพลาสติกและยางเทียม สูตรโครงสร้างของอะเซทิลีน คือ HC º CH
การเรียกชื่อสารประกอบแอลไคน์ จะเป็นไปตามระบบ IUPAC คือ เปลี่ยนคำลงท้ายเป็น ไอน์ (-yne)
C2H2 = Ethyne, C3H4 = Propyne,
C4H6 = Butyne, C5H8 = Pentyne,
C6H10 = Hextyne, C7H12 = Heptyne,
C8H14 = Octyne, C9H16 = Nontyne,
C10H18 = Decyne
สมบัติทางกายภาพของแอลไคน์
1.เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว
2.แอลไคน์ที่มีขนาดโมเลกุลเล็กๆ เป็นก๊าซมีกลิ่นเฉพาะตัว ไม่มีสี
3.ไม่ละลายน้ำ แต่ละลายในตัวทำละลายไม่มีขั้ว เช่น เบนซีน โทลูอีน
4.มีความหนาแน่นน้อยกว่าน้ำ
5.จุดเดือดและจุดหลอมเหลวต่ำ เพราะแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย สำหรับแอลไคน์ที่คาร์บอนต่อกันเป็นสายยาว จุดเดือดจะเพิ่มขึ้นเมื่อมวลโมเลกุลเพิ่มขึ้น
6.จุดเดือดของแอลไคน์สูงกว่าของแอลคีนและแอลเคนที่มีคาร์บอนเท่ากันและมีโครงสร้างลักษณะเดียวกัน
1.เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว
2.แอลไคน์ที่มีขนาดโมเลกุลเล็กๆ เป็นก๊าซมีกลิ่นเฉพาะตัว ไม่มีสี
3.ไม่ละลายน้ำ แต่ละลายในตัวทำละลายไม่มีขั้ว เช่น เบนซีน โทลูอีน
4.มีความหนาแน่นน้อยกว่าน้ำ
5.จุดเดือดและจุดหลอมเหลวต่ำ เพราะแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย สำหรับแอลไคน์ที่คาร์บอนต่อกันเป็นสายยาว จุดเดือดจะเพิ่มขึ้นเมื่อมวลโมเลกุลเพิ่มขึ้น
6.จุดเดือดของแอลไคน์สูงกว่าของแอลคีนและแอลเคนที่มีคาร์บอนเท่ากันและมีโครงสร้างลักษณะเดียวกัน
ปฏิกิริยาเคมีของแอลไคน์
แอลไคน์มีพันธะสามซึ่งเป็นสารประกอบไม่อิ่มตัว จึงเกิดปฏิกิริยาการเติมคล้ายแอลคีน ปฏิกิริยาของแอลไคน์ที่สำคัญ ได้แก่
1. ปฏิกิริยาการเผาไหม้ ถ้าเผาไหม้ในบรรยากาศปกติหรือในบริเวณที่มี O2 น้อยจะให้เขม่า (มากกว่าแอลคีน) แต่ถ้าเผาในบริเวณที่มีออกซิเจนมากเกินพอ จะไม่ให้เขม่าเมื่อเกิดปฏิกิริยาสมบูรณ์จะได้ H2O และ CO2 ซึ่งเขียนเป็นสมการทั่วไปเหมือนแอลเคนและแอลคีน
2. ปฏิกิริยาการเติม จะเกิดที่บริเวณพันธะสาม (เหมือนกับแอลคีนซึ่งเกิดที่พันธะคู่)
ปฏิกิริยาการเติมไฮโดรเจน (hydrogenation) โดยมี Pt, Ni, หรือ Pd เป็นตัวเร่งปฏิกิริยาจะได้ผลิตภัณฑ์เป็นแอลคีนหรือแอลเคนตามปริมาณของ H2 ที่ใช้ ถ้า 1 โมลของแอลไคน์รวมตัวกับ H2 1 โมลจะได้แอลคีน แต่ถ้าใช้ H2 โมล จะได้แอลเคน
ประโยชน์ของแอลไคน์
ส่วนใหญ่เป็นประโยชน์ของอะเซทิลีน (C2H2) ดังนี้
1.ใช้ C2H2 เป็นเชื้อเพลิงโดยผสมกับ O2 เรียกว่า Oxyacetylene ให้ความร้อนสูงมาก (อุณหภูมิประมาณ 3000 0C ) จึงใช้ในการเชื่อมโลหะ
ส่วนใหญ่เป็นประโยชน์ของอะเซทิลีน (C2H2) ดังนี้
1.ใช้ C2H2 เป็นเชื้อเพลิงโดยผสมกับ O2 เรียกว่า Oxyacetylene ให้ความร้อนสูงมาก (อุณหภูมิประมาณ 3000 0C ) จึงใช้ในการเชื่อมโลหะ
2.ใช้ C2H2 เป็นสารตั้งต้นในการเตรียมสารอื่นๆ เช่น
ก. เตรียมพลาสติก polyvinyl chloride (P.V.C) , polyvinyl ether, polyvinyl acetate
ข. เตรียม acetylene tetrachloride (C2H2Cl4) และ trichloroacetylene หรือ trilene (C2HCl3) ซึงใช้ประโยชน์ในการซักแห้ง
ค. เตรียมสารอื่นๆ เช่น acetaldehyde, acetone และ acetic acid
ง. ใช้เร่งการออกดอกของพืชบางชนิด เช่น สับปะรด
ก. เตรียมพลาสติก polyvinyl chloride (P.V.C) , polyvinyl ether, polyvinyl acetate
ข. เตรียม acetylene tetrachloride (C2H2Cl4) และ trichloroacetylene หรือ trilene (C2HCl3) ซึงใช้ประโยชน์ในการซักแห้ง
ค. เตรียมสารอื่นๆ เช่น acetaldehyde, acetone และ acetic acid
ง. ใช้เร่งการออกดอกของพืชบางชนิด เช่น สับปะรด
อะโรมาติกไฮโครคาร์บอน (aromatic hydrocarbon)
อะโรมาติกไฮโดรคาร์บอน เป็นสารประกอบไฮโดรคาร์บอนไม่อิ่มตัวประเภทหนึ่ง มีโครงสร้างหลักเป็นวงเบนซีน (benzene ring) ภายในวงเบนซีน จะมีคาร์บอน 6 อะตอมต่อกันเป็นวง โดยมีพันธะเดี่ยวและพันธะคู่สลับกันไปอะโรมาติก ไฮโดรคาร์บอนตัวแรกคือ เบนซีน (benzene)ซึ่งมีสูตรโมเลกุลเป็น C6H6 และมีสูตรโครงสร้างดังนี้
H ในเบนซีนอาจจะถูกแทนที่ด้วยอะตอมหรือหมู่อะตอมเพียง 1 หมู่ หรือมากกว่า 1 หมู่ก็ได้
ถ้าถูกแทนที่ด้วยหมู่แอลคิลจะยังคงเป็นอะโรมาติก ไฮโดรคาร์บอน แต่ถ้าถูกแทนที่ด้วยหมู่ฟังก์ชันอื่นๆ เช่น - Cl, - OH, -NH2 จะกลายเป็นอนุพันธ์ของอะโรมาติก ไฮโดรคาร์บอน
สมบัติทางกายภาพของอะโรมาติกไฮโดรคาร์บอน
1.เป็นสารประกอบที่มีกลิ่นเฉพาะตัว
2.เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว ดังนั้นจึงไม่ละลาย แต่ละลายได้ดีในตัวทำละลายไม่มีขั้ว เช่น CCl4 อีเทอร์
3.มีความหนาแน่นน้อยกว่าน้ำ
4.จุดเดือดและจุดหลอมเหลวเพิ่มขึ้นตามขนาดของโมเลกุลที่ใหญ่ขึ้น
5.เป็นสารประกอบไม่อิ่มตัว มีพันธะคู่มาก เมื่อเผาไฟจึงมีเขม่ามาก (มากกว่าแอลคีนและแอลไคน์)
ตารางแสดง สมบัติบางประการของอะโรมาติก ไฮโดรคาร์บอนบางชนิด
การเรียกชื่ออะโรมาติก ไฮโดรคาร์บอน
สำหรับอะโรมาติก ไฮโดรคาร์บอนที่เป็นโมเลกุลเล็กๆ และไม่ซับซ้อนเรียกชื่อโดยใช้เบนซีนเป็นชื่อหลัก ถ้าหมู่แอลคิล 1 หมู่ มาเกาะที่วงแหวนเบนซีน ให้เรียกชื่อหมู่อัลคิลนำหน้า benzene (เบนซีน) แต่ถ้ามีหมู่แอลคิลมากกว่า 1 หมู่ จะต้องบอกตำแหน่งของหมู่แอลคิลด้วย ตัวอย่างการเรียกชื่อ
ปฏิกิริยาเคมีของอะโรมาติก ไฮโดรคาร์บอน
1.ปฏิกิริยาการเผาไหม้ ถ้าเผาไฟในบรรยากาศปกติจะมีเขม่าจำนวนมาก เพราะเกิดปฏิกิริยาไม่สมบูรณ์ แต่ถ้าเผาในที่ๆ มี O2 จำนวนมากเกินพอ จะเกิดปฏิกิริยาสมบูรณ์ ไม่มีเขม่า และได้ H2O และ CO2 เป็นผลิตภัณฑ์ เหมือนกับไฮโดรคาร์บอนอื่นๆ เช่น
2C2H6 + 15O2 -----> 12CO2 + 6H2O
C7H8 + 9O2 ------> 7CO2 + 4H2O
2.ปฏิกิริยาการแทนที่ พิจารณาตัวอย่างปฏิกิริยาของเบนซีนดังนี้
ก. Halogenation เบนซีนจะทำปฏิกิริยากับ Cl2 หรือ Br2 ได้โดยมีผงเหล็ก หรือ FeCl3 เป็นตัวเร่งปฏิกิริยา
เกิดปฏิกิริยาการแทนที่และได้ก๊าซ HX เช่น
เกิดปฏิกิริยาการแทนที่และได้ก๊าซ HX เช่น
ข. Nitration ทำปฏิกิริยากับ HNO3 และ H2SO4 เข้มข้น
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
ศึกษากันเสร็จแล้ว มาลองทำแบบฝึกหัดกันดูนะคะ
1. จงเรียกชื่อ
IUPAC ของสารที่มีสูตรโครงสร้างดังต่อไปนี้
1.1
CH3
- C º C
- CH3
1.2 
 CH
º CH - CH - CH - CH3
CH
º CH - CH - CH - CH3
CH3 CH3
2. ไฮโดรคาร์บอนที่มีจำนวนคาร์บอนเท่ากัน
และโครงสร้างลักษณะเดียวกันจะมีลำดับจุดเดือดเป็นอย่างไร
ก. แอลเคน >
แอลไคน์ > แอลคีน ค. แอลไคน์ >
แอลเคน > แอลคีน
ข. แอลคีน> แอลไคน์ > แอลเคน ง. แอลเคน >
แอลคีน > แอลไคน์
3. สารใดใช้เป็นสารตั้งต้นในการเตรียมพลาสติก
ก.
CH4 ,C2H6 ค. C2H6
, C3H8
ข.
CH4 ,C3H8 ง. C2H2 , C2H4
4. สารประกอบไฮโดรคาร์บอนในข้อใดที่ใช้เร่งการออกดอกของพืช เช่น
สับปะรด ?
ก. C2H2 ค. C2H4
ข.
C2H6 ง. C3H6
มาดูเฉลยกันนนนน
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
1 ))) 1.1 มีชื่อ IUPAC คือ 2 - butyne
1.2 มีชื่อ IUPAC
คือ 3, 4 –
dimetlyl– 1 - pentyne
2 ))) ค. แอลไคน์ > แอลเคน > แอลคีน
3 ))) ง. C2H2 , C2H4
4 ))) ก. C2H2
มาลองทำข้อสอบของอะโรมาติกกันบ้างนะ
1.สมบัติทางกายภาพของอะโรมาติกไฮโดรคาร์บอนมีอะไรบ้าง
2. บอกและอธิบายวิธีทางเคมี
พร้อมทั้งเขียนปฏิกิริยาที่ใช้ทดสอบความแตกต่างระหว่าง benzene
และtoluene
3.ข้อใดต่อไปนี้ถูกต้องเกี่ยวกับอะโรมาติกไฮโดรคาร์บอน
ก.
เมือเผาไหม้จะให้เปลวไฟที่มีเขม่ามาก
ข. สามารถเปลี่ยนสีสารละลาย
KMnO4 ได้
ค. สามารถฟอกสีสารละลายโบรมีนในคาร์บอนเตตระคลอไรด์ในที่สว่างได้
ง. มีพลังงานพันธะระหว่างคาร์บอนมากกว่าพลังงานพันธะระหว่างคาร์บอนของแอลคีน
4. ถ้าไฮโดรเจน 3
อะตอมในเบนซีนถูกแทนที่ด้วยหมู่เมทิล 3
หมู่ จะได้สารที่เป็นอนุพันธ์ของเบนซีนกี่ชนิด
ก. 2 ชนิด ข. 3 ชนิด ค. 4 ชนิด ง.
5 ชนิด
5. สาร A มีสูตรโมเลกุล พิจารณาสารประกอบต่อไปนี้
1. ไซโคลแอลเคน 2. ไซโคลแอลเคน 2 วงติดกัน
3. ไซโคลแอลคีน 4. วงของไซโคลแอลเคนและไซโคลแอลคีน
5. สารประกอบแอลไคน์ 6. สารประกอบอะโรมาติก
สาร A
อาจเป็นสารประกอบใดได้บ้าง
ก. 6 เท่านั้น ข. 1, 4 และ
5
ค. 1,
2 และ
5 ง. 2, 3 และ5
เฉลยกันเถอะะะ
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
1. ตอบ 1. เป็นสารประกอบที่มีกลิ่นเฉพาะตัว
2. เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว
ดังนั้นจึงไม่ละลาย แต่ละลายได้ดีในตัวทำละลายไม่มีขั้ว เช่น CCl4
อีเทอร์
3. มีความหนาแน่นน้อยกว่าน้ำ
3. มีความหนาแน่นน้อยกว่าน้ำ
4. จุดเดือดและจุดหลอมเหลวเพิ่มขึ้นตามขนาดของโมเลกุลที่ใหญ่ขึ้น
5. เป็นสารประกอบไม่อิ่มตัว มีพันธะคู่มาก เมื่อเผาไฟจึงมีเขม่ามาก (มากกว่าแอลคีนและแอลไคน์)
2. ตอบ 1. การออกซิเดชัน โดยโทลูอีนจะเกิดปฏิกิริยาออกซิเดชันที่หมู่เมทิลได้
ขณะที่เบนซีนไม่เกิดปฏิกิริยา
2. การเปรียบเทียบอัตราเร็วในการเกิดปฏิกิริยา electrophilic substitution เช่น การแทนที่โบรมีนในแอโรมาติก โทลูอีนจะฟอกจางสีของโบรมีนได้เร็วกว่าเบนซีน
3. ตอบ ก.
เมื่อเผาไหม้จะให้เปลวไฟที่มีเขม่ามาก
4. ตอบ ข. 3 ชนิด
5. ตอบ ง. 2, 3 และ5
จัดทำโดย
1.นายพีรวิชญ์ รักษาสุวรรณ เลขที่ 2
2.นายพันธวัช พันชะโก เลขที่ 8
3.นางสาวฑิฆัมพร ภูมรินทร์ เลขที่ 12
4.นางสาวทิพย์วิมล ปุ้มกระโทก เลขที่ 16
5.นางสาวทักษพร ใคร่กระโทก เลขที่ 27
6.นางสาวปพิชญา ภูมิโคกรักษ์ เลขที่ 30
7.นางสาวปิยธิดา ทาทอง เลขที่ 32
ชั้นมัธยมศึกษาปีที่ 6/3
โรงเรียนบุญวัฒนา จังหวัดนครราชสีมา